Le microbiote allié de notre cerveau
L’intestin est un auxiliaire précieux du cerveau. Si bien que l’idée de mettre au point des « psychobiotiques » pour atténuer le stress ou la dépression fait son chemin. Avec l’espoir de traiter de nombreuses autres pathologies, comme le diabète ou Parkinson.
 Rien de plus simple qu’un système digestif. Du moins en apparence. La part de pizza que nous venons d’avaler est broyée dans la bouche, dégradée dans l’estomac, puis glisse dans l’intestin grêle qui absorbe les nutriments nécessaires. Le côlon en extrait l’eau, digère certaines fibres puis élimine le reste par l’anus sous forme de matière fécale. Trivial ! » Mais cette vision simpliste qui a influencé des générations de médecins et de chirurgiens est dépassée : l’intestin est bien plus délicat et puissant. C’est un petit cerveau « , martèle Emeran Mayer, gastro-entérologue, directeur exécutif du Center for Neurobiology of Stress de l’université de Californie à Los Angeles (États-Unis) et auteur de The Mind-Gut Connection.
Rien de plus simple qu’un système digestif. Du moins en apparence. La part de pizza que nous venons d’avaler est broyée dans la bouche, dégradée dans l’estomac, puis glisse dans l’intestin grêle qui absorbe les nutriments nécessaires. Le côlon en extrait l’eau, digère certaines fibres puis élimine le reste par l’anus sous forme de matière fécale. Trivial ! » Mais cette vision simpliste qui a influencé des générations de médecins et de chirurgiens est dépassée : l’intestin est bien plus délicat et puissant. C’est un petit cerveau « , martèle Emeran Mayer, gastro-entérologue, directeur exécutif du Center for Neurobiology of Stress de l’université de Californie à Los Angeles (États-Unis) et auteur de The Mind-Gut Connection.
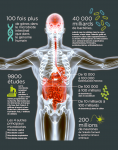
De fait, il possède un système nerveux qui lui est propre et sa paroi cellulaire est colonisée par 40.000 milliards de bactéries de mille espèces différentes qui forment son précieux microbiote, autrefois appelé » flore intestinale « , aux multiples fonctions. » Ce “petit” cerveau communique en permanence avec le “grand” qui est dans notre tête grâce à une autoroute à plusieurs voies « , poursuit en souriant Emeran Mayer (voir l’infographie ci-dessous). Tant et si bien qu’émerge une nouvelle et très prometteuse piste thérapeutique : soigner le microbiote pour soulager le cerveau.
Une piste « microbiote-cerveau » à explorer
Dans le laboratoire Micalis à l’Institut national de la recherche agronomique (Inra) de Jouy-en-Josas (Essonne), un bâtiment design en bordure de prairie, les chercheurs étudient ce phénomène en élevant des souris très particulières. D’apparence normale, elles sont en fait dépourvues de microbiote (« axéniques »). Sylvie Rabot, microbiologiste, et Laurent Naudon, neuroscientifique, affinent leur nouvelle expérience : deux groupes de rongeurs, l’un composé d’axéniques, l’autre non, vont subir séparément des stress pendant cinq semaines, alors que deux autres groupes resteront tranquilles. « En examinant leur cerveau, nous découvrirons si le microbiote influence ou non la production de nouveaux neurones, d’ordinaire perturbée par le stress », explique Laurent Naudon.
Cette hypothèse improbable n’aurait pas vu le jour sans les travaux pionniers (2004) de Nobuyuki Sudo, de l’université de Kyushu (Japon). L’équipe japonaise a démontré que des souris axéniques sont plus stressées que la normale et « suractivent » l’axe du stress, dit hypothalamo-hypophyso-surrénalien. Inédit ! La piste « microbiote-cerveau » est lancée.
Dès lors, les chercheurs découvrent que l’absence de microbiote modifie aussi l’expression de gènes cérébraux impliqués dans la croissance des neurones et la formation des synapses, et qu’elle est liée à une moindre étanchéité de la barrière dite hémato-encéphalique, qui protège le cerveau de toute intrusion.
Mieux ! Les souris axéniques présentent également un défaut de mémorisation et de comportement social. Plus déroutant, les perturbations cessent lorsque les scientifiques implantent un microbiote chez ces rongeurs qui en étaient dépourvus. Seule la suractivation de l’axe du stress demeure inchangée, sauf si l’implantation de bactéries intestinales se fait précocement, dès l’adolescence.
De quoi imaginer d’éventuelles applications chez l’humain. « Une colonisation bactérienne perturbée (par une naissance prématurée ou la prise d’antibiotiques) pourrait donc être à l’origine de troubles chez l’enfant, suggère Sylvie Rabot. Si c’est le cas, on pourrait rétablir une maturation normale en agissant assez tôt sur le microbiote. » Jusqu’où cette action pourrait-elle aller ?
En 2011, une étude menée par Premysl Bercik, de l’université McMaster (Canada), en donne une idée : chez une souris axénique de souche BALB/c, sélectionnée pour son comportement anxieux, les chercheurs ont procédé à une transplantation fécale (lire p. 30) du microbiote d’une souris NIH Swiss, non anxieuse.
Résultat : une baisse de l’anxiété chez la première ainsi qu’une augmentation d’un facteur de croissance nerveux dans l’hippocampe, la zone de la mémorisation dans le cerveau. John Cryan, professeur du département d’Anatomie et neurosciences de l’université de Cork (Irlande), parvient, lui, à réduire le comportement anxieux d’une souris BALB/c en lui faisant consommer pendant 28 jours une souche d’une bactérie lactique (Lactobacillus rhamnosus), un probiotique (bactérie vivante).
« D’autres études, également avec des probiotiques, ont cependant apporté des résultats contradictoires avec des lignées différentes de souris et d’autres souches de bactéries lactiques, relativise Sylvie Rabot. Il n’y a pas encore de consensus. »
Quoi qu’il en soit, comment une bactérie peut-elle modifier le cerveau jusqu’à agir sur le comportement ?
« Une des voies possibles est le nerf vague [qui relie le système digestif et le cerveau, lire S. et A. n° 834], répond John Cryan.
Pour tester cette hypothèse, nos animaux ont subi une vagotomie (ablation du nerf vague), puis ont été traités par Lactobacillus rhamnosus. »
Constatation : l’effet des probiotiques sur le comportement cesse. « Lactobacillus rhamnosus pourrait servir comme antidépresseur et anxiolytique grâce à ses effets sur le nerf vague, conclut le chercheur. Des études sont en cours pour examiner l’effet de ce microbe sur la réponse au stress chez l’humain. »
Des bactéries contre la dépression
Reste, en effet, à démontrer le lien entre microbiote et troubles mentaux chez l’humain. Déjà, quelques études identifient une différence d’espèces bactériennes entre patients dépressifs et ceux qui ne le sont pas. Entre autres, Ali Naseribafrouei, de l’université Arctique (Norvège), trouve, à partir d’échantillons fécaux, davantage de bactéries du groupe des Bacteroidetes et moins de celui des Lachnospiraceae chez les patients dépressifs.
Cause ou conséquence ? Difficile à dire.
Cependant, l’idée que l’on pourrait atténuer l’anxiété, le stress, voire la dépression en modifiant le microbiote fait déjà son chemin. Par exemple, au laboratoire ETAP-Éthologie appliquée (Vandoeuvre-lès-Nancy, Meurtheet-Moselle), deux souches de bactéries, Lactobacillus helveticus et Bifidobacterium longum, ont été administrées à deux groupes de volontaires sains pendant trente jours, les résultats étant comparés à ceux de volontaires prenant un placebo. Au terme de l’expérience, une réduction significative du stress et de l’anxiété a été constatée dans le groupe « probiotique ».
En 2013, Emeran Mayer a, quant à lui, observé, pour la première fois en IRM fonctionnelle que la consommation de lait fermenté (enrichi en probiotiques) pendant trente jours — toujours versus placebo — chez des volontaires sains « modifie l’activité des régions cérébrales qui contrôlent la gestion centrale des émotions et sensations ». « C’est une démonstration de faisabilité, remarque le gastroentérologue.
Il s’agit maintenant d’étudier des patients en clinique. » L’objectif : disposer un jour de « psychobiotiques », que John Cryan définit comme « des bactéries vivantes ayant un effet positif sur la santé mentale ». Le marché des probiotiques (y compris les laits fermentés), estimé à 50 milliards de dollars dès 2018 (chiffre de l’agence de conseil en stratégie nutrition Nutrikéo), a de quoi motiver les recherches. Et pas uniquement pour la dépression…
Manipuler le microbiote pour améliorer les troubles de l’autisme
L’autisme pourrait en effet bénéficier lui aussi d’une meilleure connaissance du microbiote. Lors du premier symposium international Microbiote pour la santé et la maladie consacré à ce trouble en 2014 (université de l’Arkansas, États-Unis), les chercheurs ont établi que les enfants autistes souffrent d’un taux élevé de problèmes digestifs (constipation, diarrhée, etc.) et que les symptômes digestifs sont corrélés à la sévérité de la pathologie.
Bien qu’il puisse s’agir de conséquences du trouble, et non de causes, les scientifiques s’accordent sur un fait : « Si le microbiote intestinal joue vraiment un rôle causal dans les symptômes autistiques, alors sa manipulation peut potentiellement être exploitée comme une approche thérapeutique pour améliorer les symptômes ou les troubles associés, dont les symptômes gastrointestinaux. »
Déjà en 2000, un antibiotique (vancomycine), prescrit contre la bactérie pathogène Clostridium difficile, avait atténué les symptômes d’un petit groupe d’enfants autistes, le temps du traitement. Et un traitement oral avec une souche de Bacteroides fragilis humaine administré à des souriceaux au comportement autistique avait fait reculer leurs anomalies digestives. Selon Richard Frye, neurologue, organisateur du symposium, les scientifiques sont désormais en train de planifier des essais cliniques importants en suivant cette piste.
Un biomarqueur précoce de la maladie de Parkinson
La gravité des symptômes parkinsoniens serait également corrélée à la concentration de certaines bactéries intestinales, les entérobactéries. Selon Filip Scheperjans, chercheur au département de Neurologie de l’Hôpital universitaire d’Helsinski (Finlande), le dysfonctionnement gastro-intestinal — la constipation notamment — précède souvent de plusieurs années l’apparition des symptômes moteurs au cours de la maladie de Parkinson. Il suggère que le microbiote pourrait ainsi constituer un bon biomarqueur précoce de la maladie (Movement Disorders, 2015).
Une cible thérapeutique contre la sclérose en plaques
Enfin, en Irlande, à l’université de Cork, l’équipe de John Cryan a découvert que le microbiote était nécessaire à la souris pour réguler les gènes de la myélinisation (maturation des fibres nerveuses) du cortex préfrontal, région clé du cerveau pour les fonctions cognitives supérieures. « Il est probable que des signaux envoyés par l’intestin au cerveau freinent les processus de myélinisation, affirme-t-il.
Le microbiote est donc une cible thérapeutique potentielle pour les troubles psychiatriques impliquant ce fonctionnement » (Transl. Psychiatry, 2016). Un espoir pour la sclérose en plaques, où les défenses immunitaires s’en prennent aux cellules chargées de la myélinisation du cerveau.
Les recherches sur les nombreuses implications du microbiote sur la santé ne font que commencer. « Nous n’en sommes qu’aux balbutiements, confirme Sylvie Rabot. Mais une chose est déjà sûre : prendre soin de son microbiote ne peut être que bénéfique pour la santé en général et le cerveau en particulier. »
Article issu du mensuel Sciences et Avenir n°835 (septembre 2016)
Autre source : ON EN PARLE ICI AUSSI

