Actualités
L’alerte de la F.D.A à propos des potentiels problèmes liés à l’arrêt du GILENYA du laboratoire Novartis
Voici l’alerte qui émane de la F.D.A, à propos des « graves » problèmes potentiellement liés à l’arrêt du GILENYA.
Lien de l’article (via Google Traduction)
La FDA met en garde contre une grave aggravation de la sclérose en plaques après l’arrêt du médicament Gilenya (fingolimod)
La Food and Drug Administration (FDA) avertit que, lorsque le médicament Gilenya (fingolimod) est arrêté pour le traitement de la sclérose en plaques (MS), la maladie peut devenir bien pire qu’avant le début du traitement ou pendant que je le prenais. Cette aggravation de la SEP est rare mais peut entraîner une invalidité permanente. En conséquence, nous avons ajouté un nouvel avertissement concernant ce risque aux informations pharmacologiques figurant sur l’ étiquette du médicament Gilenya et au Guide des médicaments du patient.
Gilenya est l’un des nombreux médicaments approuvés pour le traitement d’une forme récurrente de SEP, qui comprend des périodes au cours desquelles les symptômes de la SP s’aggravent. Le médicament a été approuvé aux États-Unis en 2010. (suite…)

C’est sympa toutes ses bonnes nouvelles en ce moment à propos de certains traitements #SEP : cette fois-ci, c’est le Lemtrada – Alemtuzumab
— Cliquez sur ce lien pour voir la page d’alerte de la F.D.A —
La FDA met en garde les consommateurs contre le risque de cas rares mais graves d’accidents vasculaires cérébraux et de déchirures de la muqueuse des artères de la tête et du cou associés au médicament Lemtrada, un médicament connu sous le nom d’Alemtuzumab. Ces problèmes peuvent entraîner une invalidité permanente et même la mort.
Lemtrada, développé par Genzyme, une société du groupe Sanofi, a été approuvé par la FDA pour le traitement des formes récurrentes de sclérose en plaques en novembre 2014. Le médicament a été lancé aux États-Unis en décembre 2014, avec un avertissement encadré concernant le risque d’auto-immunité, de réactions à la perfusion, et des tumeurs malignes. L’étiquette a été mise à jour en octobre dernier afin d’inclure le risque de cholécystite aiguë acalculeuse (inflammation aiguë de la vésicule biliaire en l’absence de calculs biliaires).
Lemtrada a rapporté un chiffre d’affaires annuel de 474 millions d’euros à Sanofi en 2017 et un chiffre d’affaires trimestriel de 99 millions d’euros au troisième trimestre de 2018.
Alemtuzumab, sous la marque Campath, a été approuvé en mai 2001 pour le traitement d’un type de cancer appelé leucémie lymphocytique chronique à cellules B (B-CLL). Afin de prévenir l’utilisation non conforme d’Alemtuzumab, Sanofi avait retiré le médicament des marchés américain et européen en 2012.
L’organisme de réglementation américain a indiqué que l’étiquette du médicament Campath serait également mise à jour afin d’inclure les risques liés aux accidents vasculaires cérébraux et aux déchirures de la muqueuse des artères de la tête et du cou.
Détail(s), action(s), descriptions & effets secondaires – possibles – (et interactions – possibles -) du GILENYA
RAPPEL à toutes fins utiles : il faut rappeler que ce médicament semble être efficace chez certaines personnes touchées par une #SEP (rémittente la plupart du temps).
De +, les informations citées ci-dessous ne sont que des « précautions » & « alertes » sur ce qu’il est (serait) susceptible de vous arriver. Ou pas. 😉
Ces infos proviennent d’un site Canadien (pas Français). Les spécificités sont pourtant les mêmes pour tous les pays qui l’utilisent.
Comment ce médicament agit-il ? Quels sont ses effets ?
Le fingolimod appartient à la classe des médicaments appelés modulateurs des récepteurs de la sphingosine-1-phosphate (S1P). Il s’utilise dans le traitement de la forme cyclique (poussées-rémissions) de la sclérose en plaques ou SEP.
Le fingolimod ne constitue pas un traitement curatif de la SEP, mais il aide à diminuer le nombre de poussées (les récidives), à réduire l’inflammation dans le cerveau (les lésions cérébrales mises en évidence par la technique de l’imagerie par résonance magnétique ou IRM), et à ralentir l’accumulation des problèmes physiques imputables à la SEP (l’évolution de la déficience). Les personnes qui l’utilisent n’ont généralement pas observé une réponse satisfaisante pour le moins à un autre traitement contre la SEP, ou leur organisme n’ont pas supporté d’autres traitements. (suite…)
Voir le cerveau jusqu’à la glie
Elles sont indispensables au bon fonctionnement des neurones et leur dysfonctionnement peut entraîner des pathologies. Les cellules gliales sont pourtant encore négligées par la recherche. Plongée dans la glie à l’occasion de la Semaine du cerveau, qui se tient jusqu’au 18 mars
Invariablement, lorsque l’on parle du cerveau, ce sont toujours les neurones qui attirent toute notre attention. Pourtant, ces derniers ne seraient rien sans les cellules gliales qui les stimulent, les nourrissent et les protègent. Longtemps négligée, la glie – ces quelque 150 milliards de cellules qui entourent nos 100 milliards de neurones – semble aujourd’hui acquérir progressivement ses lettres de noblesse.
Une reconnaissance encore timide, mais amplement méritée au vu de son rôle fondamental. Car comprendre les cellules gliales permettrait non seulement de mieux cerner le fonctionnement de notre cerveau et l’essence de nos comportements, mais également d’appréhender de manière plus nette les mécanismes à l’œuvre dans certaines affections du système nerveux, comme la dépression, la maladie d’Alzheimer, ou encore Parkinson.
Le microbiote allié de notre cerveau
L’intestin est un auxiliaire précieux du cerveau. Si bien que l’idée de mettre au point des « psychobiotiques » pour atténuer le stress ou la dépression fait son chemin. Avec l’espoir de traiter de nombreuses autres pathologies, comme le diabète ou Parkinson.
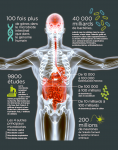 Rien de plus simple qu’un système digestif. Du moins en apparence. La part de pizza que nous venons d’avaler est broyée dans la bouche, dégradée dans l’estomac, puis glisse dans l’intestin grêle qui absorbe les nutriments nécessaires. Le côlon en extrait l’eau, digère certaines fibres puis élimine le reste par l’anus sous forme de matière fécale. Trivial ! » Mais cette vision simpliste qui a influencé des générations de médecins et de chirurgiens est dépassée : l’intestin est bien plus délicat et puissant. C’est un petit cerveau « , martèle Emeran Mayer, gastro-entérologue, directeur exécutif du Center for Neurobiology of Stress de l’université de Californie à Los Angeles (États-Unis) et auteur de The Mind-Gut Connection.
Rien de plus simple qu’un système digestif. Du moins en apparence. La part de pizza que nous venons d’avaler est broyée dans la bouche, dégradée dans l’estomac, puis glisse dans l’intestin grêle qui absorbe les nutriments nécessaires. Le côlon en extrait l’eau, digère certaines fibres puis élimine le reste par l’anus sous forme de matière fécale. Trivial ! » Mais cette vision simpliste qui a influencé des générations de médecins et de chirurgiens est dépassée : l’intestin est bien plus délicat et puissant. C’est un petit cerveau « , martèle Emeran Mayer, gastro-entérologue, directeur exécutif du Center for Neurobiology of Stress de l’université de Californie à Los Angeles (États-Unis) et auteur de The Mind-Gut Connection.
De fait, il possède un système nerveux qui lui est propre et sa paroi cellulaire est colonisée par 40.000 milliards de bactéries de mille espèces différentes qui forment son précieux microbiote, autrefois appelé » flore intestinale « , aux multiples fonctions. » Ce “petit” cerveau communique en permanence avec le “grand” qui est dans notre tête grâce à une autoroute à plusieurs voies « , poursuit en souriant Emeran Mayer (voir l’infographie ci-dessous). Tant et si bien qu’émerge une nouvelle et très prometteuse piste thérapeutique : soigner le microbiote pour soulager le cerveau.
Alerte de la F.D.A (traduit en Français)
La FDA a également émis une alerte de sécurité en novembre 2018, mettant en garde contre un risque d’aggravation de l’incapacité dans les semaines ou les mois qui suivent l’arrêt de l’utilisation de Gilenya. Bien que ce risque soit rare, l’agence a indiqué qu’il pouvait être grave et entraîner une invalidité permanente.
Alerte de la F.D.A (extrait en Anglais)
The FDA also issued a safety alert in November 2018, warning of a risk of worsening disability within weeks or months of stopping Gilenya’s use. While this risk is rare, the agency noted that it can be severe and result in permanent disability.
A propos du Gilenya (histo)
A ce jour, 11 mars 2021, toujours aucune information supplémentaire n’a été communiquée par quelconque organisme que ce soit.
J’ai bien sûr interrogé mon propre neurologue qui n’était à priori pas au courant. Pas au courant dans un service neurologie à Paris. J’en doute énormément à la vue de tous les congrès SEP qui sont organisés à travers le monde et dont le sujet doit être connu.
Les infirmières ne semblent pas au courant (dont une infirmière du service que je connais depuis des années, et pour qui j’ai une confiance aveugle en son honnêteté). Pas du tout comme mon neurologue donc.
Dernière minute. 26/11/2018 : INFORMATION IMPORTANTE à propos du GILENYA
Une information a été diffusée · aux Etats-Unis · par le laboratoire Novartis, fabricant du GILENYA, pour signaler le danger & l’aggravation de la maladie si le traitement était arrêté (de nombreux cas ont été signalés).
Pour l’instant en France, aucune information à ce sujet. + d’infos à venir… (Vous pouvez trouver des informations – en anglais – sur ce site)
Voici le document pdf mis à la disposition des utilisateurs du Gilenya. (document issu du site Européen sur les médicaments).
Document .pdf 2018 : Cliquez sur l’icône pdf pour le télécharger (61 pages – 61 pages !!) ou cliquez sur cette adresse (en français) :
https://www.ema.europa.eu/documents/product-information/gilenya-epar-product-information_fr.pdf
En version anglaise :
https://www.ema.europa.eu/documents/product-information/gilenya-epar-product-information_en.pdf
La version 2019 du document a évolué : il y a désormais 74 pages… :
https://www.ema.europa.eu/en/documents/product-information/gilenya-epar-product-information_fr.pdf
Modification de l’autorisation de délivrance de QIZENDAY (Biotine)
QIZENDAY (laboratoires MEDDAY), plus connu sous le nom de Biotine, est un médicament destiné aux adultes ayant une forme progressive de Sclérose en Plaques (primaire ou secondaire).
En juillet 2016, l’Agence Nationale de Sécurité du Médicament (ANSM) avait accordé une autorisation temporaire d’utilisation afin que les neurologues puissent le prescrire aux patients souffrant de SEP. En octobre 2017, plus de 6500 personnes recevaient ce traitement .
En novembre 2017, le laboratoire a préféré retirer sa demande d’autorisation de mise sur le marché en attendant les résultats d’une étude de phase III qui se déroule aux Etats-Unis et dont les résultats seront connus en 2020.
L’ANSM vient de faire savoir qu’elle a décidé de modifier son autorisation à compter du 15 octobre 2018 .
Après cette date, le traitement par QIZENDAY ne pourra plus être prescrit à de nouveaux patients. Par contre, QIZENDAY restera disponible pour les personnes recevant déjà ce traitement et ayant montré des signes d’amélioration de leur état de santé apprécié par leur neurologue après une durée d’un an, et sans effet indésirable. En l’absence d’amélioration ils ne recevront plus le traitement.
Quelle que soit votre situation vis-à-vis de ce traitement et si vous avez la moindre interrogation, nous vous invitons à en parler avec votre neurologue traitant. (source association)
[ source ]
La « chouette » campagne de l’Afsep du mois de novembre 2018 – La #SEP à travers Laura
Cette campagne d’information auprès du grand public, a été préparée par l’association AFSEP et l’agence de com Josiane.
Cette campagne d’affichage s’accompagne aussi d’un clip de sensibilisation à la maladie (bien trouvé) : la petite vieille