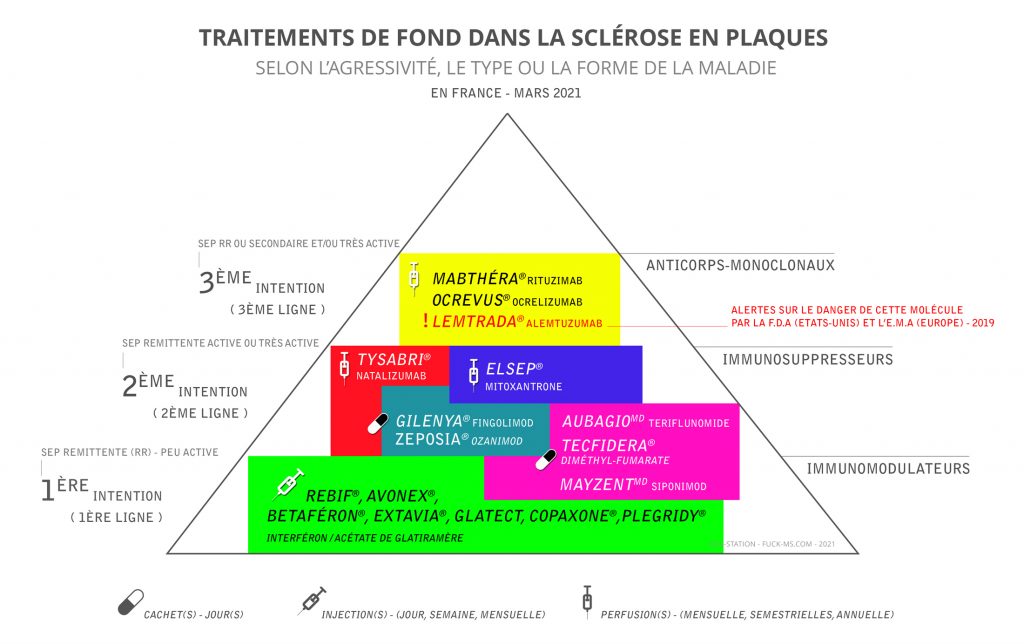
Les traitements
Médicaments modificateurs de l’évolution de la maladie
Les traitements de fond agissent sur le système immunitaire en empêchant l’agression du système nerveux par le système immunitaire.
Les médicaments de première intention sont l’interféron et l’acétate de Glatiramère. Il s’agit d’immunomodulateurs qui diminuent l’inflammation mais qui n’empêchent pas l’activité du système immunitaire. Ils réduisent d’environ 30% la fréquence des poussées. Ces médicaments sont sans risque à long terme mais ne sont pas dénués d’effets secondaires qui peuvent entraîner un arrêt de traitement.
En deuxième intention, on utilise des médicaments immunosuppresseurs plus actifs sur le processus inflammatoire comme la mitoxantrone, le natalizumab ou le fingolimod.
Pour avoir une vue d’ensemble des traitements SEP actuels (2021) : rendez-vous sur le site Canadien de lutte contre la SEP :
Mode d’action des molécules actuelles
Les traitements faisant appel aux immunomodulateurs, habituellement suivis de manière prolongée, s’avèrent le meilleur moyen actuel de ralentir l’évolution naturelle de la SEP. Pour décider de recourir ou non à un médicament contre la SEP, il faut tenir compte de divers facteurs comme le style de vie, le mode d’évolution de la maladie, les effets indésirables connus des immumodulateurs et les risques et bienfaits potentiels de chacun d’eux.
Autres molécules en cours d’essais cliniques (phase III) – 2021
Une batterie de traitements, immunomodulateurs et immunosuppresseurs sont testés en phase 3 en ce moment, avril 2021 (dans certains hôpitaux). La plupart du temps il s’agit d’anticorps monoclonaux. Les noms des traitements : Ponesimod, Ozanimod, Azathioprine, Mycophenolate, Ofatumumab, Toclizumab, Eculizumab. Cliquez-ici pour en savoir +
Aubagio (tériflunomide)

Aubagio (tériflunomide) – Genzyme, a Sanofi company
SEP cyclique (poussées-rémissions)
- Un comprimé de 14 mg tous les jours
L’Aubagio est prescrit en monothérapie aux personnes atteintes de SEP cyclique (poussées-rémissions) dans le but de réduire la fréquence des poussées cliniques et de freiner la progression des incapacités physiques chez ces personnes.
La prescription de ce médicament doit être réservée aux médecins expérimentés dans le diagnostic et la prise en charge de la SEP.
Les profils d’innocuité et d’efficacité de l’Aubagio chez les jeunes de moins de 18 ans n’ont pas encore été établis, et ce médicament doit être utilisé avec prudence chez les personnes âgées de 65 ans ou plus.
L’Aubagio est contre-indiqué chez les femmes enceintes ou chez les femmes aptes à procréer qui n’utilisent pas une méthode contraceptive fiable, car il peut causer du tort au fœtus lorsqu’il est administré à des femmes enceintes. Par conséquent, toute grossesse doit être exclue avant le début d’un traitement par l’Aubagio.
L’Aubagio est également contre-indiqué chez les personnes : hypersensibles au tériflunomide, au léflunomide ou à l’un des ingrédients non médicinaux compris dans la formulation du médicament; sous traitement par le léflunomide; atteintes d’une insuffisance hépatique grave.
Avonex

Avonex – (interféron bêta-1a) – Biogen
SEP cyclique (poussées-rémissions)
SEP progressive secondaire accompagnée de poussées
Syndrome clinique isolé (SCI)
- Une injection intramusculaire de 30 µg par semaine
Avonex est indiqué pour le traitement :
– De la forme cyclique (poussées-rémissions) de la SEP, dans le but de freiner la progression de la maladie, de diminuer la fréquence des poussées de SEP et de réduire le nombre et le volume des lésions cérébrales mises en évidence par l’imagerie par résonance magnétique (IRM).
– Le traitement des personnes dont l’état risque d’évoluer vers une SP cliniquement certaine (SPCC). Il est administré dans le but de retarder l’apparition de cette maladie et de diminuer le nombre et le volume des lésions cérébrales actives révélées par l’IRM.
Avonex ne peut être prescrit qu’aux patients dont l’état risque d’évoluer vers une SPCC et qui, de plus, présentent des lésions cérébrales mises en évidence par l’IRM. De plus, avant d’instituer un traitement par Avonex, il convient d’éliminer toute autre maladie possible.
Aucune étude appropriée ni bien contrôlée n’a été effectuée sur la prise d’Avonex par les femmes enceintes.
On ne sait donc pas si ce médicament est excrété dans le lait maternel.
Betaseron

Betaseron – (interféron bêta-1b) – Bayer HealthCare Pharmaceuticals
SEP cyclique (poussées-rémissions)
SEP progressive secondaire accompagnée de poussées
SCI
- Une injection sous-cutanée de 250 µg tous les deux jours
Betaseron est indiqué pour :
-
le traitement de la forme cyclique (poussées-rémissions) de la SEP chez les personnes ambulatoires, dans le but de diminuer la fréquence des poussées;
-
le traitement des personnes atteintes d’une forme progressive secondaire de SEP, dans le but de freiner l’aggravation des incapacités et de réduire la fréquence des poussées;
-
le traitement des personnes dont l’état risque d’évoluer vers une SEP cliniquement certaine (SPCC) et qui présentent au moins deux lésions cérébrales révélées par l’IRM. Ce traitement vise à retarder l’apparition d’une SPCC. Cela dit, avant d’instaurer un traitement par Betaseron, il importe d’éliminer toute autre maladie possible.Betaseron est contre-indiqué chez : les personnes ayant une hypersensibilité connue à l’interféron bêta naturel ou recombinant, à l’albumine humaine ou à n’importe quel autre composant de la formulation; les femmes enceintes; les personnes présentant une maladie hépatique décompensée.
Copaxone

Copaxone – (acétate de glatiramère) – Teva Neuroscience
SEP cyclique (poussées-rémissions)
SCI
- Une injection sous-cutanée de 20 mg tous les jours ou 40 mg trois fois par semaine.
COPAXONE (acétate de glatiramère) est indiqué pour :
20 mg/mL 1 fois par jour :
le traitement des patients ambulatoires atteints de sclérose en plaques (SEP) rémittente, y compris ceux qui ont subi un événement démyélinisant unique et qui ont des lésions typiques de la SEP détectées par examens d’imagerie par résonance magnétique (IRM) cérébrale :
-
pour diminuer la fréquence des poussées cliniques.
-
pour réduire le nombre et le volume des lésions cérébrales actives détectées par examens d’IRM.
40 mg/mL 3 fois par semaine :
le traitement des patients ambulatoires atteints de SEP rémittente :
-
pour diminuer la fréquence des poussées cliniques.
-
pour réduire le nombre et le volume des lésions cérébrales actives détectées par examens d’IRM.
Extavia
ExtaviaMD – (interféron bêta-1b) – Novartis Pharmaceuticals Inc.
SEP cyclique (poussées-rémissions)
SEP progressive secondaire accompagnée de poussées
SCI
-
Une injection sous-cutanée de 250 µg tous les deux jours
Extavia est indiqué pour :
-
le traitement de la forme cyclique (poussées-rémissions) de la SEP, chez les personnes ambulatoires, dans le but de diminuer la fréquence des poussées;
-
le traitement des personnes atteintes d’une forme progressive secondaire de SEP, dans le but de freiner l’aggravation des incapacités et de réduire la fréquence des poussées;
-
le traitement des personnes dont l’état risque d’évoluer vers une SEP cliniquement certaine (SPCC) et qui présentent au moins deux lésions à l’IRM cérébrale. Ce traitement vise à retarder l’apparition d’une SPCC. Cela dit, avant d’instaurer un traitement par Extavia, il importe d’éliminer toute autre maladie possible.
Extavia est contre-indiqué chez : les personnes ayant une hypersensibilité connue à l’interféron bêta naturel ou recombinant, à l’albumine humaine ou à n’importe quel autre composant de la formulation; les femmes enceintes; les personnes présentant une dépression grave et (ou) ayant des idées suicidaires; les personnes ayant une maladie hépatique décompensée.
[ source et + d’infos ]
Gilenya

Gilenya – (fingolimod) – Novartis Pharmaceuticals
SEP cyclique (poussées-rémissions)
Recommandé aux personnes qui ne répondent pas bien aux autres traitements modificateurs de l’évolution de la SEP ou qui ne les tolèrent pas.
- Une capsule de 0,5 mg tous les jours
Le Gilenya est prescrit en monothérapie comme traitement de deuxième intention en vue de réduire la fréquence des poussées et de freiner la progression des incapacités physiques chez les personnes atteintes de SEP cyclique (poussées-rémissions) qui ont eu une réaction d’intolérance ou qui n’ont pas bien répondu à au moins un autre médicament utilisé dans le traitement de la SEP.
On ne sait pas encore si le Gilenya est sans danger et efficace pour les jeunes de moins de 18 ans et les adultes de plus de 65 ans.
Le Gilenya n’a pas été approuvé pour le traitement des personnes qui ont présenté un syndrome clinique isolé (SCI) ou qui sont atteintes d’une forme progressive de SEP.
Le Gilenya est également contre-indiqué chez les personnes qui : présentent certaines maladies du cœur; sont hypersensibles (allergiques) au fingolimod ou à l’un des composants du produit ou du contenant; sont immunodéficientes, à la suite d’une maladie ou d’un traitement immunosuppresseur; présentent une infection active grave ou une infection chronique active telle que l’hépatite ou la tuberculose; sont atteintes d’un cancer actif (sauf s’il s’agit d’un carcinome basocellulaire); présentent une maladie du foie grave; sont enceintes ou allaitantes.
Glatect
GlatectMC – (acétate de glatiramère)
SEP cyclique (poussées-rémissions)
SCI
- Une injection sous-cutanée de 20 mg tous les jours
Le Glatect (acétate de glatiramère pour injection) est indiqué pour le traitement des patients ambulatoires atteints de sclérose en plaques (SEP) rémittente, y compris les patients qui ont présenté un seul événement démyélinisant et qui ont des lésions typiques de la sclérose en plaques à l’imagerie par résonance magnétique (IRM) cérébrale :
– pour réduire la fréquence des poussées cliniques.
– pour réduire le nombre et le volume des lésions cérébrales actives détectées par imagerie par résonance magnétique (IRM) cérébrale.
L’innocuité et l’efficacité de Glatect pour le traitement de la forme chronique progressive de la sclérose en plaques n’ont pas été établies.
Aussi, il importe d’éliminer toute autre maladie possible avant d’instituer un traitement par le Glatect.
Le Glatect est contre-indiqué chez les personnes qui présentent une hypersensibilité à ce médicament ou à l’un des composants du produit ou du contenant.
Lemtrada
attention : des graves problèmes ont été rapportés par l’ANSM en 2019 : voir l’alerte sur le sujet
LemtradaMC – (alemtuzumab) – Genzyme, a Sanofi company
SEP cyclique (poussées-rémissions)
- Administré en présence de signes d’activité de la SEP chez des personnes n’ayant pas bien répondu aux autres traitements modificateurs de l’évolution de la SEP.
- Une perfusion intraveineuse quotidienne de 0,5 mg pendant cinq jours consécutifs, la première année du traitement, puis une perfusion quotidienne de 0,5 mg pendant trois jours consécutifs, la seconde année du traitement
Le Lemtrada (alemtuzumab) est indiqué pour le traitement des adultes atteints de SEP cyclique (poussées-rémissions) chez qui les examens cliniques et les résultats d’imagerie montrent des signes d’activité de la maladie. Ces personnes doivent également avoir présenté une réponse inadéquate à l’interféron bêta ou à tout autre immunomodulateur.
Le traitement par le Lemtrada doit être amorcé et supervisé par un neurologue spécialisé dans le traitement de la SEP, au fait des profils d’innocuité et d’efficacité du Lemtrada.
Les profils d’innocuité et d’efficacité du Lemtrada chez les jeunes de moins de 18 ans et chez les personnes de plus de 65 ans ne sont toujours pas connus.
L’emploi du Lemtrada n’est pas recommandé chez les femmes enceintes. Les femmes en âge de procréer doivent quant à elles recourir à une méthode de contraception fiable durant les séries de traitement et pendant les quatre mois qui suivent chacune d’elles. Aucune donnée ne permet de conclure que le Lemtrada peut être excrété dans le lait maternel, mais un risque existe.
Le Lemtrada est contre-indiqué chez les personnes qui : présentent une hypersensibilité à l’alemtuzumab ou à l’un des composants du Lemtrada ou de son contenant; sont infectées par le virus de l’immunodéficience humaine (VIH); sont atteintes de tuberculose en phase active ou latente; présentent de graves infections actives; ont un cancer actif; reçoivent un traitement antinéoplasique ou immunosuppresseur; ont des antécédents de leucoencéphalopathie multifocale progressive (LEMP).
Ocrevus

Ocrevus MC – (ocrélizumab) – Hoffmann-La Roche Ltée
Traitement des personnes atteintes de SEP cyclique (poussées-rémissions) chez qui les examens cliniques et les résultats d’imagerie montrent des signes d’activité de la maladie.
- Dose initiale : perfusion intraveineuse de 300 mg, suivie d’une autre perfusion intraveineuse de 300 mg 2 semaines plus tard.
- Doses subséquentes : perfusion intraveineuse unique de 600 mg tous les 6 mois.
L’utilisation de l’Ocrevus est réservée aux personnes adultes atteintes de SEP cyclique (poussées-rémissions) chez qui les examens cliniques et les résultats d’imagerie montrent des signes d’activité de la maladie.
L’Ocrevus est contre-indiqué chez les personnes qui présentent une infection active par le virus de l’hépatite B ou qui ont eu une réaction potentiellement mortelle liée à l’administration de l’Ocrevus par perfusion.
[ source et + de détails ]
Plegridy

PlegridyMC – (interféron bêta-1a) – Biogen
SEP cyclique (poussées-rémissions)
- Une injection sous-cutanée de 125 µg une fois toutes les deux semaines.
Plegridy est indiqué pour le traitement de la forme cyclique (poussées-rémissions) de la SEP, dans le but de freiner l’aggravation des incapacités et de réduire la fréquence des poussées.Les profils d’innocuité et d’efficacité de Plegridy chez les personnes atteintes d’une forme progressive (primaire ou secondaire) de sclérose en plaques n’ont pas encore été établis.
Ils ne sont pas connus non plus chez les jeunes de moins de 18 ans et les adultes de plus de 65 ans.
Par ailleurs, aucune étude appropriée ni bien contrôlée n’a été effectuée sur la prise de Plegridy par les femmes enceintes. On ne sait donc pas si ce médicament est excrété dans le lait maternel.
Rebif

RebifMD – (interféron bêta-1a) – EMD Serono
SEP cyclique (poussées-rémissions)
SEP progressive secondaire accompagnée de poussées
SCI
- Une injection sous-cutanée de 44 µg trois fois par semaine ou une injection sous-cutanée de 22 µg trois fois par semaine
- Médicament qui existe aussi dans une seringue préremplie.
Rebif est indiqué pour le traitement :
- des formes récurrentes de SEP (soit des formes caractérisées par des poussées, telles la forme cyclique (poussées-rémissions) et la forme progressive secondaire qui s’accompagne de poussées), dans le but de diminuer la fréquence et la gravité des poussées, de freiner l’aggravation des incapacités physiques, de restreindre le recours aux stéroïdes, de réduire le nombre d’hospitalisations attribuables à la SP ainsi que le nombre de lésions cérébrales mises en évidence par l’imagerie par résonance magnétique (IRM);
- syndrome clinique isolé (SCI) : des personnes dont l’état risque d’évoluer vers une SP cliniquement certaine (SPCC) et qui présentent au moins deux lésions cérébrales révélées par l’IRM. Ce traitement vise à retarder l’apparition d’une SPCC.
Tecfidera

TecfideraMC – (diméthylfumarate) – Biogen
SEP cyclique (poussées-rémissions)
- Deux capsules de 120 mg, deux fois par jour ou une capsule de 240 mg, deux fois par jour
Le Tecfidera est recommandé en monothérapie contre la forme cyclique de la SP dans le but de réduire la fréquence des poussées et de retarder la progression de l’incapacité.
La prescription de ce médicament doit être réservée aux médecins expérimentés dans le diagnostic et la prise en charge de la SEP.
Le Tecfidera est contre-indiqué chez les personnes qui présentent une hypersensibilité à ce médicament, à l’un des composants du produit ou du contenant. Les personnes atteintes de SEP devraient consulter leur médecin pour savoir si le Tecfidera constitue pour eux une option thérapeutique.
Le profil d’innocuité et d’efficacité du Tecfidera chez les jeunes de moins de 18 ans et chez les adultes de plus de 65 ans n’est toujours pas connu.
Aucune étude clinique adéquate et bien menée n’a encore eu cours sur le Tecfidera chez les femmes enceintes ou allaitantes. On ne sait donc pas si ce médicament est excrété dans le lait maternel.
Tysabri

Tysabri MD – (natalizumab) – Biogen
SEP cyclique (poussées-rémissions)
Recommandé chez les personnes qui ne répondent pas bien aux autres traitements modificateurs de l’évolution de la SEP ou qui ne les tolèrent pas.
- Une perfusion intraveineuse de 300 mg toutes les quatre semaines
Tysabri est indiqué en monothérapie pour le traitement de la forme cyclique (poussées-rémissions) de la SEP, dans le but de diminuer la fréquence des poussées de SEP, de freiner la progression de la maladie et de réduire le nombre et le volume des lésions cérébrales mises en évidence par l’imagerie par résonance magnétique (IRM). Il est généralement recommandé pour les personnes atteintes de SEP qui ne répondent pas bien aux autres traitements modificateurs de l’évolution de la SEP ou qui ne les tolèrent pas.
Tysabri n’a pas été approuvé pour le traitement des personnes qui ont présenté un syndrome clinique isolé (SCI) ou qui sont atteintes d’une forme progressive de SEP.
Zeposia
ZeposiaMD(ozanimod)
Le Zeposia est un médicament oral modificateur de l’évolution de la maladie, employé dans le traitement de la forme cyclique (poussées-rémissions) de la SP chez l’adulte. Il fait partie de la classe de médicaments appelés modulateurs des récepteurs de la sphingosine-1-phosphate (S1PR).
Le Zeposia est indiqué pour le traitement des personnes adultes qui sont atteintes de sclérose en plaques cyclique (poussées-rémissions).
On ne sait pas encore si le Zeposia est sans danger et efficace chez les jeunes de moins de 18 ans et les adultes de plus de 65 ans.
Le Zeposia est un médicament oral qui se présente sous la forme d’une capsule de 0,92 mg et se prend sur une base quotidienne, avec ou sans nourriture.
Un traitement par le Zeposia doit être amorcé à l’aide d’un échantillon de départ prévu pour sept jours et comportant les doses progressives indiquées dans le tableau ci-dessous. L’amorce progressive du traitement pourrait réduire le risque d’une diminution du rythme cardiaque.
- Du 1er au 4e jour
- Prendre 0,23 mg (capsule gris pâle)
- 1 fois par jour
- Du 5e au 7e jour
- Prendre 0,46 mg (capsule gris pâle et orange)
- 1 fois par jour
- À partir du 8e jour
- Prendre 0,92 mg (capsule orange)
- 1 fois par jour
Évitez de consommer des aliments à haute teneur en tyramine (plus de 150 mg) tels que des produits vieillis, fermentés, saurés, fumés ou marinés. Le fait de consommer de tels aliments tout en suivant un traitement par le Zeposia peut entraîner une augmentation de la tension artérielle.
Ne cessez pas de prendre le Zeposia sans en parler préalablement avec votre fournisseur de soins de santé.
N’omettez aucune dose.
Entamez votre traitement par le Zeposia à l’aide de l’échantillon de départ prévu pour sept jours.
Si vous omettez de prendre une dose de Zeposia durant les 14 premiers jours de votre traitement, parlez-en à votre fournisseur de soins de santé. Il vous faudra alors reprendre votre traitement en ayant recours à un autre échantillon de départ pour sept jours.
+ d’infos sur le site de la H.A.S (haute autorité de santé)